Principes van Confocale Laser Scanning Microscopie
Confocale Laser Scanning Microscopie (CLSM) is een bijzondere vorm van licht-
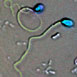
microscopie, die zowel in reflectie, transmissie als in fluorescentie mode kan worden toegepast. Met de CLSM techniek kunnen scherpere beelden van microscopische objecten (hier getekend als blauwe bolletjes) verkregen worden dan met een gewone (wijd-veld) microscoop (zie het
verschil; meer over
microscopie in het algemeen bij de website "optical Microscopy Primer", met links naar
excitatie en emissie van fluorochromen en naar de bouw van
fluorescentie microscopen ...). Dit komt doordat in confocale microscopen, itt standaard-microscopen, alleen de lichtstralen die afkomstig zijn van het laagje in het object dat
precies in-focus is (situatie in C) tot de detector worden toegelaten. Alle overige stralen uit hoger- en lager-gelegen lagen (situatie in A), die normaalgesproken ook aan beeldvorming meedoen, worden geblokkeerd. Dit geschiedt dmv een diafragma (= pinhole; groene steep in de figuur), waarvan de positie overeenkomt met de brandpuntsafstand van het object (vandaar de naam
confocaal; B geeft de combinatie van A en C weer, waarbij alleen de paarse lichtstralen de pinhole passeren. Meer details en gegevens over de
stralengang in CLSM in de figuur op de website van Olympus ...). De opnamen van dunne laagjes in het object, ook optische coupes genoemd, worden dus verkregen zonder dat het object werkelijk in plakjes gesneden hoeft te worden.
De lichtbron in CLSM wordt gevormd door een of meerdere
lasers (
Light
Amplification by the
Stimulated
Emission of
Radiation; Meer over
lasers ...). Lasers hebben de eigenschap dat ze -regelbaar- krachtig en monochromatische licht uitstralen dat zich leent tot bundeling tot een puntvormige lichtbron, wat het oplossend vermogen ten goede komt. In sommige systemen wordt deze lichtbundel mbv bewegelijke spiegels volgens een xy-
scanpatroon over het object heen geschenen. Simultaan hieraan wordt het reflectie, transmissie of fluorescentie signaal punt-per-punt opgevangen en tot een
xy beeld gereconstrueerd. Om de scanfuntie te bewerkstelligen is in andere microscopen een Nipkow-schijf ipv spiegels ingebouwd en in weer andere een bewegende kruistafel (meer over
scanning methoden ...). CLSM biedt de mogelijkheid om zwakke emissie-signalen, die met een gewone microscoop nauwelijks waar te nemen zouden zijn, gevoelig te detecteren en zodanig te versterken dat als resultaat een helder en contrastrijk beeld is weergegeven op een computer monitor (dit is mogelijk ihb dankzij het gebruik van fotomultipliers buizen =
PMTs en charge-coupled device = CCD cameras, samen met digitale beeldverwerking).
| Laserbak |
 |
| Lasers en andere apparatuur in de bak onder de monitortafel1 = Argon laser, 2 = ventilator voor de AR laser, 3 = 633 nm HeNe laser, 4 = 561 nm laser, 5 = 594 nm laser, 6 = regeleenheden |
Meer informatie over de
theorie van CLSM,
'gewone' CLSM,
Multiphoton confocale microscopie, en het verschil tussen
single versus multiphoton CLSM-technieken (dr. Bruce Jenks, FNWI). Aanbeveling: krijg een life indruk van de mogelijkheden van een confocale microscoop met de
CLSM simulator. Wie meer wil weten over de technische eigenschappen van de hier getoonde confocale microscoop en de mogelijkheden om dit instrument te gebruiken wordt verwezen naar de webpagina van het
Gemeenschappelijk Instrumentarium
Multi-dimensionele CLSM: x-y-z-t-lambda-imaging
Door de afstand tussen het object en het objectief van de microscoop met heel kleine stapjes (<< 1/100 mm per stap) geleidelijk aan te variëren kunnen er op alle hoogten (
z dimensie) in dit object scherpe
xy-beelden worden opgenomen. Zo verkrijgt men dus een z-stapel van xy opnamen, vergelijkbaar met een stapel pannekoeken (zie een animatie van een
xyz-serie bestaande uit 27 plaatjes verkregen met stappen van telkens 6 micrometer hoogteverschil). De xyz opnamen kunnen vervolgens tot een geheel worden samengesteld dmv projecties.Verder kunnen er opnamen gemaakt worden op verschillende tijdstippen (
t), waardoor bewegingen en veranderingen in structuren overtijd bestudeerd kunnen worden (
t dimensie). Tenslotte kan het emissielicht van fluorescerende stoffen op grond van verschillen in kleur (=golflengte licht, afgekort
lambda) over verschillende kanalen worden gedetecteerd. Zo kunnen in een en hetzelfde preparaat meerdere specifieke merkstoffen, ieder met een eigen fluorescentiespectrum, tegelijkertijd gescheiden waargenomen worden, wat nuttig kan zijn om de relatie tussen verschillende structuren te kunnen achterhalen.
FRAP (Fluorescence Recovery After Photobleaching) is een methode die toegepast wordt om de mobiliteit van stoffen in een monster te analyseren: eerst wordt het object plaatselijk weggebleekt met een hoge dosis laserlicht en daarna wordt het herstel van fluorescentie vastgesteld, wat een functie is van de migratie van deeltjes/moleculen vanuit de omgeving naar het donkere deel toe.
FRET (Fluorescence Resonance Energy Transfer) is een andere bijzondere techniek die informatie oplevert over de afstand tussen twee type -fluorescerende- moleculen met specifieke FRET-eigenschappen, bijv. een activator en een receptor; hierbij wordt excitatie-licht energie door de ene molecuul geabsorbeerd en naar de andere stof 'onder water' doorgegeven, maar alleen indien de twee naburige moleculen binnen een bepaalde straal van elkaar verkeren, waardoor de tweede molecuul fluorescentie-licht gaat uitstralen.
| x-y-z-t en lambda opnamen |
|
| 
|
| xyz: de ruimtelijke dimensies | t: de tijd dimensie | lambda: de golflengte/kleur dimensie |
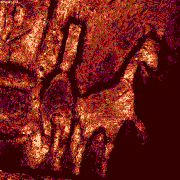
| Klik op het plaatje om een series van 27 plaatjes af te spelen die telkens op 6 micrometer hoogteverschil zijn opgenomen.
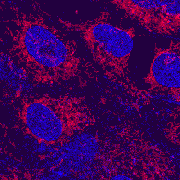
| Klik op het plaatje om een tijdsserie af te spelen waarin bewegingen in levende cellen te volgen zijn.
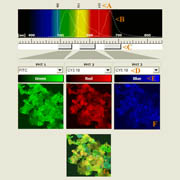
| Klik op het plaatje om een zoom-in illustratie te krijgen met verklaringen over multi-kleur fluorescentie imagen. Zie xyz-lamba animatie |
| Deze galoperende paardjes van minuscuul formaat steken in relief uit boven op de Brandenburger poort op de Duitse 20 Eurocent muntstukken. De kleuren in deze opnamen geven een indicatie van de intensiteit van het gereflecteerde licht. | Deze fibroblasten zijn met twee kleurstoffen gelabeld; de celkernen zijn in het blauw weergegeven en de mitochondria in het rood (geindexeerde kleuren = 'pseudocolor'). |
In het getoonde voorbeeld zijn bacterievlokken gekleurd met drie verschillende fluorescerende stoffen (FITC, CY3 en CY5), ieder met een eigen excitatie en emissie profiel. |